引用文獻網址:Taylor & Francis Online
結直腸癌是全世界癌症死亡的前三大主因之一,外科切除手術仍然是主要的治療方法,但有近半成的患者在術後會出現復發及轉移,而作為替代治療方案的化學療法,由於其嚴重的副作用及癌細胞的抗藥性,導致治療效果不佳。
近年來使用脂微體 (Liposome) 等奈米載體將化療藥物包覆在內以提升給藥效率的策略正在蓬勃發展中,以有幾種產品在臨床試驗中展現出對治療結直腸癌的有效性,但缺乏對癌細胞的專一性仍是一大隱憂。
外泌體作為一種天然的奈米載體,在結構上與脂微體相似,但不同的地方在於外泌體從母細胞中被分泌出來後,會在表面攜帶一些來自母細胞的生物標示物,使得外泌體在體內循環的過程中,更傾向於被與母細胞相同種類的細胞給吸收,這種特性也被稱為“歸巢“效應 (Homing effect)。
今天分享的這篇研究便是利用外泌體的歸巢特性,先在體外大量培養結直腸的癌細胞並提取外泌體,然後在這些外泌體中包覆抗癌藥物後再送進體內對結直腸癌細胞做針對性的標靶攻擊。
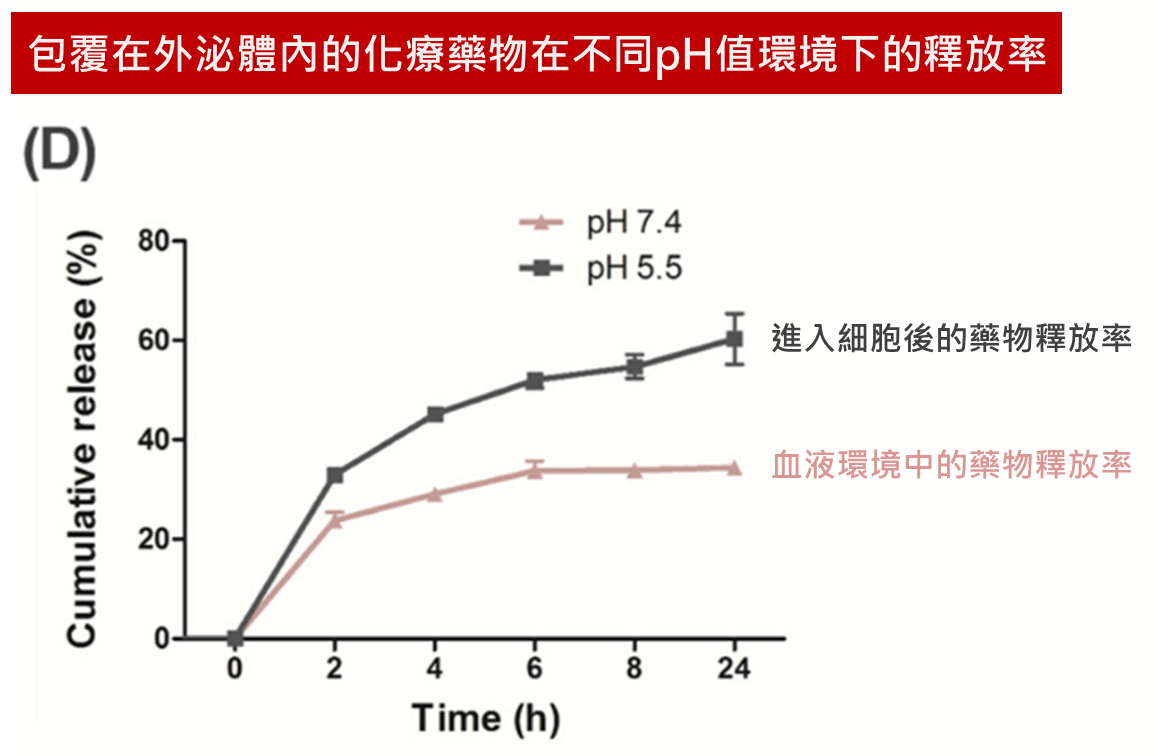
研究人員首先測試了包覆在外泌體內的藥物在不同pH值環境下的釋放情形,分別為代表血液環境的pH 7.4跟代表進入細胞並與溶酶體結合後的pH 5.5,結果顯示在pH 7.4的環境下24小時後只有32%左右的藥物釋放到外泌體外,而且pH 5.5的環境下24小時後則有60%左右的藥物釋放到外泌體外,這些結果顯示利用外泌體攜帶藥物的方法,可以避免藥物在血液循環系統中的過早釋放,減少藥物所造成的副作用並將藥效發揮在真正需要的目標處。
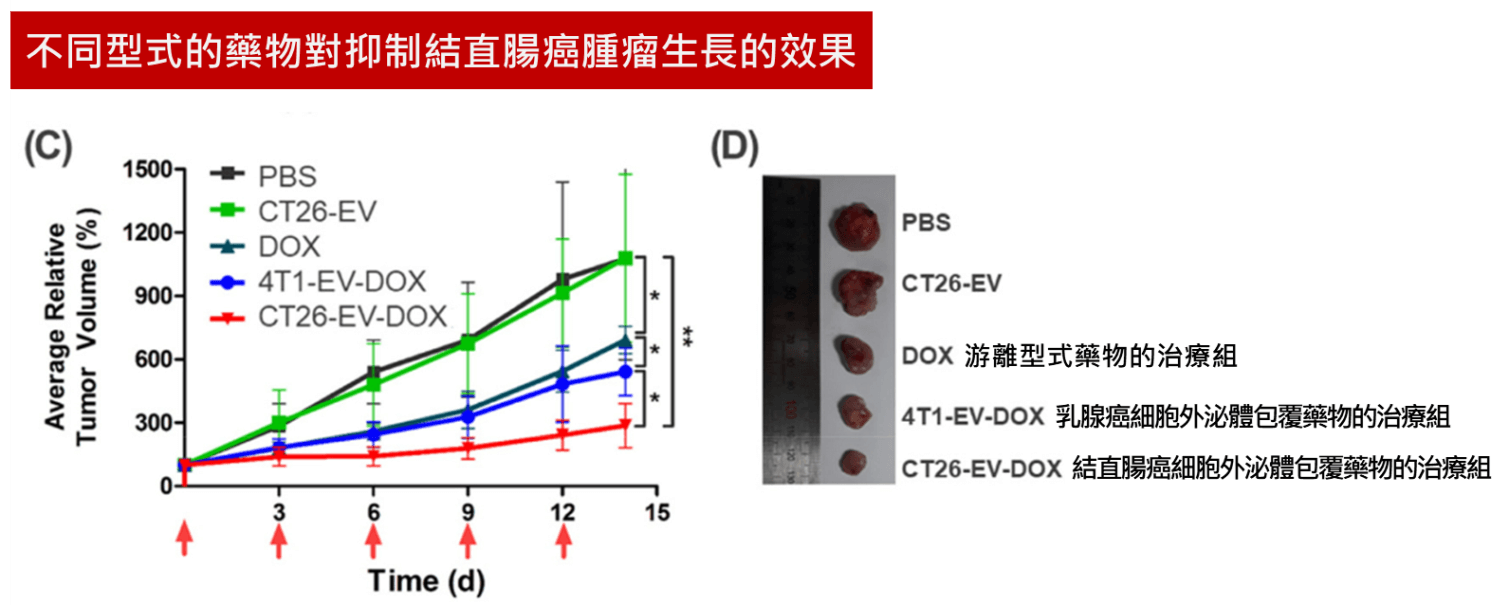
最後實際在動物實驗中驗證治療效果,比較了游離型式的藥物與包覆在結直腸癌細胞外泌體的藥物對於抑制結直腸癌腫瘤生長的效果,此外還加入了一組使用乳腺癌細胞外泌體來包覆藥物的對照組,實驗結果使用結直腸癌細胞外泌體包覆藥物的組別,其抑制腫瘤的效果遠優於直接使用游離形式的藥物跟使用乳腺癌細胞外泌體包覆藥物的組別,展現出了外泌體因歸巢特性所具備的靶向能力。