引用文獻網址:BMC
肝纖維化是肝癌發生的最主要危險因素之一,可能導致晚期肝硬化時需要進行肝移植。華南理工大學的研究團隊發現發病機制中的一個關鍵點是肝星狀細胞的活化。細胞外基質的 [形成和降解] 機制失衡以及持續的炎症,會引發一系列肝組織的病變,導致肝纖維化,最終發展成為肝硬化。
其過程中引起的肝損傷包括肝實質細胞的凋亡和星狀細胞的活化,這些都是生物體無法靠自身逆轉的現象。因此抑制肝星狀細胞的激活,可以在一定程度上改善肝纖維化,這也讓專家學者大膽設想代替器官移植的治療方法——用外源性幹細胞修復肝臟。幹細胞分泌的外泌體被發現能夠緩解肝纖維化,尤其是最近發現胚胎幹細胞衍生的外泌體具有顯著的受損組織修復能力。
華南理工大學研究團隊在Journal of nanobiotechnology發表了成果報告,比較了2D和3D培養的人胚胎幹細胞外泌體對於肝臟修復的作用,比起2D培養的幹細胞,3D懸浮培養從生理狀態來看更接近生物體內的環境,在臨床研究上的結果也更具有意義。
外泌體進入到活化的肝星狀細胞(LX-2)後,能減少促纖維化標誌物(如 COLLAGEN I 和 α-SMA)的表達、降低LX-2細胞中常見的細胞增殖標誌物(如CYCLIND、RAC1和CDC42)的基因表達等功能以及抑制活性LX-2細胞的增殖,從而抑制了體內肝纖維化的進展。在小鼠肝纖維化模型中,使用2D和3D培養的人胚胎幹細胞外泌體,皆能讓肝臟纖維化面積顯著減少。3D培養的胚胎幹細胞外泌體在減少膠原蛋白的積累上更勝過於2D培養外泌體,逆轉了肝纖維化的進展,顯示出有效的治療效果。在治療後顯著減輕了纖維化肝組織中的細胞凋亡,改善肝功能蛋白水平,幫助肝臟的修復。
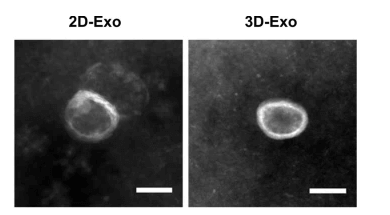 2D和3D培養的人胚胎幹細胞所分泌的外泌體型態的差異
2D和3D培養的人胚胎幹細胞所分泌的外泌體型態的差異